氧化还原反应方程式的配平方法
氧化还原反应方程式的配平,是高考的重点,同时难度较大,需要认真把握,且勤加练习。首先要把一般配平方法掌握好,然后在此基础上才可以学习一些有难度的方程式的配平。

对于一般的氧化还原反应方程式配平的基本步骤是:⑴标变价,⑵列变化,⑶求总数,⑷配系数。再根据反应的类型找出相应的方法:如歧化型(Cl2+NaOH→NaCl+NaClO3+H2O)用逆向配平法;归中型(反歧化型)(KI+KIO3+H2SO4→I2+K2SO4+H2O)用正向配平法等。下面我将例举一些较复杂的。
1、整体配平法
即把同一物质中发生化合价变化的元素的总的化合价作为一个整体来看待。
〖例1〗配平化学方程式:
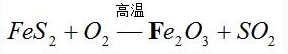
首先,标出其发生变化的元素的化合价。
其次,找出化合价的升降数,把FeS2作为一个整体,算出它升高的总的价数和O2降低的价数,

(在此用“↑”或“↓”表示此元素化合价升高或降低),再根据电子得失相等可得,FeS2的系数为4,O2的系数为11,根据原子个数守恒,可得到如下的化学方程式:

2、零价配平法
即假设某一物质中各元素的化合价均为零。
〖例2〗配平化学方程式
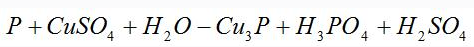
假设Cu3P中铜和磷元素的化合价均为0,再标出其它发生化合价变化的元素的化合价,计算升高和降低总数。

根据得失电子相等,则Cu3P的系数为5,H3PO4的系数为6,再根据原子个数守恒,可得到如下化学方程式:
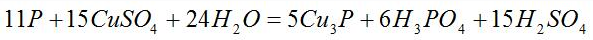
3、定价配平法
即假设某一元素反应前后的化合价不变,从而减少了发生化合价变化的元素的种类。
〖例3〗配平化学方程式

首先假设Fe元素的化合价在反应前后都为+3价,则Fe3C中只有C元素的化合价发生变化,则:
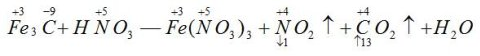
因此,NO2的系数为13,CO2的系数为1,再根据原子个数守恒,可得出如下化学方程式:
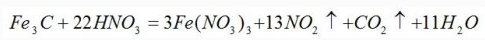
4、1,x配平法
此法主要用于有三种或三种以上化合价发生变化的复杂选自.读书学习网 www.dushuv.com 的氧化还原反应,发生化合价变化的物质为两种,具体步骤如下:
(1)定1,x。一般将反应物中化学式较复杂的物质前系数定为1,另一为x。再利用质量守恒定律,将其他物质的系数配平。
(2)由两边某原子个数守恒,列出含x的代数式;解出x,代入原化学方程式,并化分数为整数即可。
〖例4〗配平化学方程式:
可令P4O、Cl2前的系数分别为1,x,则:

另外,还有缺项的氧化还原反应的配平:一般先确定氧化剂、还原剂、氧化产物、还原产物的系数,再通过比较反应物与生成物,确定缺项(一般为H2O、H+或OH-),最后观察配平。
如何配平一般的氧化还原反应氧化还原反应的基本原则是氧化剂得电子总数和还原剂失电子总数相等,即电子守恒原则,表现为化合价降低总数和升高总数相等。
配平三原则:
1、得失电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数==化合价降低总数;
2、质量守恒:反应前后原子的种类和个数不变 ;
3.电荷守恒:离子反应前后,所带电荷总数相等。
配平基本方法:化合价升降法
1、标价态:写出反应物和生成物的化学式,标出有化合价变化的元素的化合价
2、列变化:列出反应前后元素化合价的变化值。
3、求总数:将化合价升高数和化合价降低数的最小公倍数定为电子转移总数。依据电子守恒,确定氧化剂、还原剂、氧化产物、还原产物的系数。
4、配系数:用观察法配平其他物质的化学计量数,配平后,把单线改成等号。
5、细检查:利用守恒三原则,检查是否配平
任何的氧化还原反应方程式,配平时都要严格的经过这些步骤,特别是最后的检查一定要有,以确保正确!
当然,仅仅通过一两个练习就想熟练掌握氧化还原反应的配平是不可能的,一定要多找些例子勤加练习!
智能推荐
- 下一篇:化学氧化还原反应配平 配平原则
- 上一篇:氧化还原反应配平技巧 配平口诀